Caracteristici ale sulfului
Calcogen - elemente de grup se referă la un atom de sulf. sale chimice simbol - S - prima literă a numelui latin de sulf. Compoziție substanță simplă înregistrată prin acest simbol fără index. Luați în considerare principalele puncte în ceea ce privește structura, proprietățile, prepararea și utilizarea acestui element. caracteristici de sulf vor fi prezentate detaliat posibil.
caracteristici comune si diferentele calcogen
Sulful se referă la un subgrup de oxigen. Aceasta este echipa al 16-lea în moderne perioadă lungă formează imaginea sistemului periodic (PS). Camerele învechite și indicele - VIA. Denumirile elementelor chimice ale grupului, simbolurile chimice:
Exterioare Elementele de coajă de electroni dispuse deasupra aceleași. Acesta conține toate cele șase electroni de valență care pot participa la formarea legăturilor chimice cu alți atomi. Compușii cu hidrogen au structura H2 R, de exemplu, H2 S - hidrogen sulfurat. Denumirile elementelor chimice care formează cu oxigen două tipuri de compuși: sulf, seleniu și telur. oxizi formulele generale ale acestor elemente - RO2. RO3.
Calcogen corespund substanțelor simple, care diferă foarte mult în svostvam fizic. Cele mai frecvente în scoarța tuturor calcogen - oxigen și sulf. Primul element definește două gaze, al doilea - solidele. Poloniu - elementul radioactiv - rar în scoarța terestră. In grupul de oxigen pentru proprietăți metalice poloniu scad și creșterea metalului. De exemplu, sulf - metaloid tipic și telur are un luciu metalic și conductivitatea electrică.

№ elementul 16 al DI sistemului periodic Mendeleev
relativă sulf greutate atomică - 32.064. Izotopului naturale cele mai comune 32 S (mai mult de 95% din greutate). S-au găsit în cantități mai mici nuclide cu masa atomică de 33, 34 și 36. Caracteristica sulfului asupra situației din SS și structura atomica:
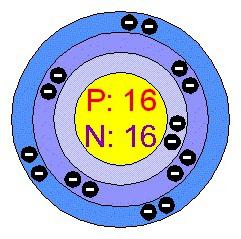
- numărul de serie - 16;
- responsabil al atomului este de 16;
- raza atomica - 0,104 nm;
- energia de ionizare a -10.36 eV;
- relativa electronegativitate - 2,6;
- gradul de oxidare în compușii - +6, +4, +2, -2;
- valență - II (-), II (+), IV (+), VI (+).
Sulful este în a treia perioadă; electroni un atom sunt situate la trei nivele de energie: prima - 2, al doilea - 8, - al treilea 6. electronii de valență sunt toate exterioare. Cand interactioneaza cu elemente de sulf mai electronegative oferă 4 sau 6 electroni, dobândind starea de oxidare tipic +6, +4. Reacțiile cu hidrogen și un atom de metal atrage electroni lipsesc două octeții pentru a umple și pentru a atinge starea de echilibru. Oxidarea în acest caz, este redus la -2.
Proprietățile fizice ale rombice și formele alotropice monoclinic
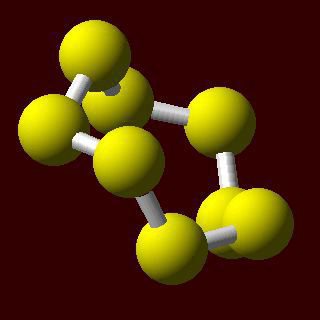
În condiții normale, atomii de sulf sunt unite într-un unghi în circuitul stabil. Ele pot fi închise într-un inel, ceea ce sugerează existența moleculelor de sulf ciclice. Compoziția lor reflecta S6 și S8 formulă.
caracteristici de sulf trebuie să fie suplimentate descrierea diferențelor dintre modificările alotropice având proprietăți fizice diferite.
Rombic sau α-sulf - forma cristalină mai stabilă. Această strălucitoare cristale galbene care constau din molecule S8. Densitatea sulf rombic este 2,07 g / cm3. cristale galben deschis de forma monoclinică formată β sulful la o densitate de 1,96 g / cm3. Punct de fierbere ajunge la 444,5 ° C
Prepararea sulfului amorf
Ce culoare este de sulf într-o stare de plastic? Aceasta este o masă maro închis, destul de similar cu pulberea galbenă sau cristale. Pentru ao obține, trebuie să topi rombice sau sulf monoclinic. La temperaturi mai mari se formează 110 ° C un lichid, în timp ce în continuare încălzirea se înnegrește la temperatura de 200 ° C devine gros și vâscos. Dacă se toarnă rapid sulful topit în apă rece, se intareste pentru a forma lanturi zig-zag, care reflectă structura formulei Sn.

Solubilitatea sulfului
Unele modificări ale unei substanțe solubile în sulfură de carbon, benzen, toluen sau amoniac lichid. Dacă se răcește lent soluțiile organice sunt formate apoi ace sulf monoclinic. Pentru evaporarea lichidelor stau cristale limpezi lamaie galben de sulf rombică. Ele sunt fragile, ele pot fi pisa cu ușurință într-o pulbere. Sulful este insolubil în apă. Cristalele scufunda pe fundul vasului, iar pulberea poate pluti pe suprafața (non-umectabilă).
chimice
Reacțiile sunt prezentate proprietățile tipice elementelor nemetalice № 16:
- sulf oxideaza metale și hidrogen, este redus la S 2- ion;
- combustia aerului și a oxigenului sunt produse di- și trioxid de sulf, care sunt anhidridele acide;
- prin reacția cu un alt element mai electronegativ - fluor - sulf, de asemenea, pierde electronii (oxideaza).
sulf liber în natură
Ce culoare este sulf în natură (nativ)? Această pulbere de culoare galben deschis, cu un miros caracteristic sau cristale galbene cu un luciu de sticlă. Depozitele sub formă de depozite, straturile cristaline de sulf găsite în zonele vulcanismului antice și moderne în Italia, Polonia, Orientul Mijlociu, Japonia, Mexic, Statele Unite ale Americii. Adesea, extracția drusenului este o frumoasă și gigant cristale unice.
hidrogen sulfurat și oxizi în natură
În regiunile vulcanice sunt situate pe suprafața compusului de sulf gazos. Marea Neagră, la o adâncime mai mare de 200 m este lipsit de viata, din cauza hidrogenului sulfurat H2 S. Formula de oxid de sulf bivalent - SO2. Trivalent - SO3. Acești compuși gazoși sunt prezenți în compoziția unora dintre petrol, gaze, ape naturale. Sulful este inclus în compoziția de cărbune. Este necesar pentru construirea multor compuși organici. Când putrefacția proteinelor de ouă de găină eliberat de hidrogen sulfurat, așa se spune adesea că mirosul de gaz de ouă stricate. Sulf aparține elementelor biogene, este necesar pentru creșterea și dezvoltarea omului, animalelor și plantelor.

Semnificația sulfurilor naturale și sulfați
Caracteristicile de sulf va fi incompletă dacă nu spun că elementul este găsit nu numai sub forma unei substanțe simple și oxid. Cele mai frecvente compuși naturali - este o sare a acidului sulfuric și hidrogen sulfurat. Sulfurilor de cupru, fier, zinc, mercur, plumb găsit în compoziția din minerale calcopirită, pirită, blendă, galenă și cinabru. Din sulfații pot fi menționate săruri de sodiu, calciu, bariu și magneziu, care formează în minerale naturale și roci (mirabilită, gips, selenit, barita, kieserit, epsomite). Toți acești compuși sunt utilizați în diferite sectoare ale economiei, sunt utilizate ca materii prime pentru prelucrarea industrială, îngrășăminte, materiale de construcții. Valoarea medicală Mare a anumitor cristaline.
substanță galbenă în stare liberă apare în natură la adâncimi diferite. Dacă este necesar, sulful este topit din roci, fără a le ridica la suprafață, în timpul pompării adâncimea aburul supraîncălzit și aerul comprimat. O altă metodă implică sublimarea rocilor zdrobite în cuptoare speciale. Alte metode implică dizolvarea bisulfura de carbon sau flotație.
cerințele industriei de sulf mari, astfel încât să se obțină substanța elementar compus utilizat. hidrogen sulfurat și sulfuri sulful este prezent sub formă redusă. Starea de oxidare a elementului este egal cu -2. oxidarea sulfului se realizează prin creșterea valorii la 0. De exemplu, metoda de sulfat de sodiu LeBlanc este redus la sulfură de carbon. Apoi, se obține din sulfura de calciu, este tratat cu dioxid de carbon și vapori de apă. Rezultată hidrogenul sulfurat este oxidat de oxigenul atmosferic în prezența unui catalizator: 2H2 S + O2 = 2H2O + 2S. Determinarea sulfului obținut în diferite moduri, uneori, oferă indicatori de puritate scăzută. Rafinarea sau purificarea se realizează prin distilare, rectificare, amestecuri de prelucrare ale acizilor.

Utilizarea sulfului în industria modernă
Granulat de sulf se duce la diferite nevoi de producție:
- Prepararea acidului sulfuric în industria chimică.
- sulfiți de producție și sulfați.
- Eliberati Preparate pentru fertilizarea plantelor, a bolilor și dăunătorilor.
- -Sulf care conține minereuri în instalațiile de extracție și chimice prelucrate pentru metale neferoase. producția concomitentă este acidul sulfuric.
- Introducerea unor clase de oțel pentru a conferi proprietăți speciale.
- cauciuc vulcanizarea Due obținut din cauciuc.
- Producție meciuri, pirotehnie, explozivi.
- Utilizarea pentru prepararea vopselelor, pigmenți, fibre sintetice.
- țesături de înălbire.

Toxicitatea de sulf și compușii săi
Particulele prafurile având un miros neplăcut, irita membranele mucoase ale cavității nazale și tractului respirator, ochii și pielea. Dar toxicitatea de sulf elementar nu este considerat deosebit de mare. Inhalarea de hidrogen sulfurat și bioxid poate provoca intoxicații grave.
Dacă prăjire a minereului cu conținut de sulf din gazele de eșapament topitorii nu sunt blocate, acestea intră în atmosferă. Conectarea cu picături și vapori de apă, oxizi de sulf și de azot dau naștere ploii așa-numita acid.
Sulf și compușii săi în agricultură
Plantele consuma ioni de sulfat împreună cu soluție de sol. Reducerea conținutului de sulf conduce la o încetinire în metabolismul celulelor verzi ale aminoacizilor și a proteinelor. Prin urmare, sulfati utilizate pentru fertilizarea culturilor agricole.

Pentru a dezinfecta case de păsări de curte, pivnițe, magazine de legume substanță simplu arse sau tratate cu facilități moderne sulfamide. oxid de sulf posedă proprietăți antimicrobiene, care au găsit mult timp aplicarea în producția de vin atunci când sunt depozitate legume și fructe. medicamente cu sulf sunt utilizate ca pesticide pentru combaterea bolilor și dăunătorilor (făinare și acarieni).
Folosit în medicină

O mare importanță pentru studiul de proprietăți medicinale de pulbere de culoare galbenă a dat mare medici din antichitate Avicenna și Paracelsus. Acesta a fost determinat ulterior că persoana nu este suficient de obtinerea de sulf de la slabeste alimentare, se confruntă cu probleme de sănătate (care includ senzația de mâncărime și exfoliere a pielii, părului și unghiilor slăbirea). Faptul este că, fără sulf afectată sinteza aminoacizilor, keratina, procese biochimice din organism.
sulf medical încorporat în unguent pentru tratamentul bolilor de piele: acnee, eczeme, psoriazis, alergii, seboree. Baile cu sulf poate calma durerea de reumatism si guta. Pentru o mai bună absorbție de către organism pentru a crea sulfamide solubile în apă. Aceasta nu este o pulbere de culoare galbenă, o substanță albă cristalină fină. Pentru aplicații în aer liber acest compus este administrat în cosmetică pentru îngrijirea pielii.
Gips a fost mult timp folosit în imobilizarea părților vătămate ale corpului. sare Glauber este prescris ca un medicament laxativ. Magnesia scade tensiunea arterială, care este utilizat în tratamentul hipertensiunii arteriale.
Sulf în istorie
Chiar și în cele mai vechi timpuri substanțe nemetalifere flori galbene atrag atentia unei persoane. Dar numai în 1789, marele chimist Lavoisier a constatat că pulberea și cristalele găsite în natură, compuse din atomi de sulf. Se credea că mirosul urât care apar în timpul arderii sale, respinge orice rău. Formula de oxid de sulf, care este obținut prin ardere - SO2 (dioxid). Această inhalare de gaze toxice este periculos pentru sănătate. Mai multe cazuri de dispariție în masă a sate întregi de oameni de pe coastele, în zonele joase de oameni de știință explica alocarea terenurilor sau a hidrogenului sulfurat de apă sau dioxid de sulf.
Invenția de praf de pușcă interes crescut în cristale galbene de către armată. Multe bătălii au fost câștigate datorită capacității de a combina stăpânilor sulfului cu alte substanțe în fabricarea explozivilor. Cel mai important compus - acid sulfuric - de asemenea, a învățat cum să folosească un timp foarte lung. În Evul Mediu, este o substanță numită ulei de vitriol și sare - sulfat. sulfat de cupru CuSO4 și FeSO4 sulfat de fier încă nu și-au pierdut importanța lor în industrie și agricultură.

