Cera - chimice, prepararea compușilor
Sulful este un grup VIa a sistemului periodic al elementelor chimice DI Mendeleev.
La nivelul energetic exterior al atomului de sulf conținut 6 electroni, care au o configurație de electroni 2 3s 3p 4. Compușii cu metale și expoziții de sulf hidrogen negativ de oxidare elemente de putere -2 compuși cu oxigen și alte nemetale activi - pozitiv +2, +4, 6. Sulful - un nemetal tipic, în funcție de tipul de conversie poate fi un agent de oxidare și un agent reducător.
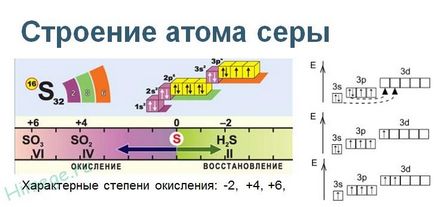
Sulful se găsește sub formă liberă (nativ) de stat și legat.
Cei mai importanți compuși cu sulf naturale:
pirita sau pirită, - FeS2
ZnS - blende sau sfaleritul (wurtzite)
PbS - Galena și Galena,
În plus, sulf prezent în țiței, cărbune naturale, gaze naturale, apele naturale (ca ion sulfat și determină o duritate „permanentă“ apă proaspătă). Un element vital pentru organismele superioare, o parte integrantă a multor proteine este concentrată în păr.
Alotropie - capacitatea aceluiași element există în diferite forme moleculare (molecule conțin un număr diferit de atomi ai aceluiași element, de exemplu, O2 și O3 S2 și S8 P2 și P4, etc ..).
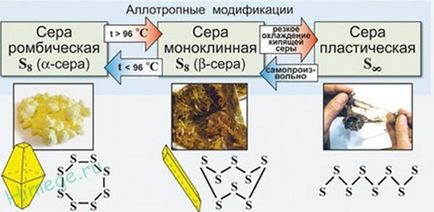
Sulful se caracterizează prin capacitatea de a forma lanțuri stabile și cicluri de atomi. Cel mai stabil S8. formând rombic și sulf monoclinic. Acest sulf cristalin - substanță galbenă casant.
lanț deschis are un plastic de sulf, substanță brună, care se obține prin călire de sulf topit (plastic sulf a devenit fragil și capătă o culoare galbenă se transformă treptat într-un rombică câteva ore).
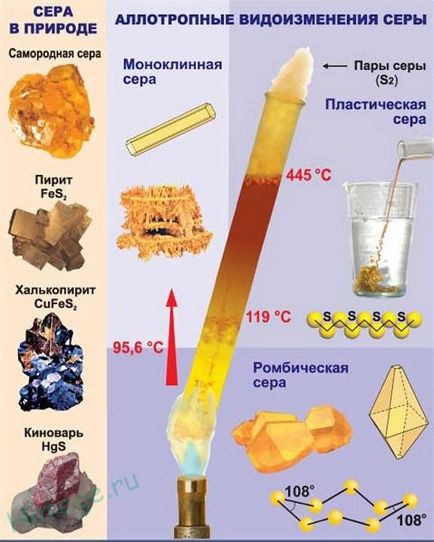
1) rombic - S8
t ° mp. = 113 ° C; r = 2,07 g / cm3
Cea mai stabila modificare.
2) monoclinic - ace galben închis
t ° mp. = 119 ° C; r = 1,96 g / cm3
Stabil la o temperatură mai mare de 96 ° C; în condiții normale, este convertită într-un rombică.
3) din material plastic - maro aspect de cauciuc) masă (amorfă
Instabil și se transformă într-un ortorombică în timpul solidificării
- Metoda industrială - topirea minereului cu abur.
- Oxidarea incompletă a hidrogenului sulfurat (oxigen):
1) sulf reacționează cu metale alcaline fără încălzire:
c alte metale (cu excepția Au, Pt) - la un t elevată °: