echilibru chimic
Revenind la procesul de producție de amoniac, exprimată prin ecuația:
Atunci când într-un volum închis, azot și hidrogen se combină pentru a forma amoniac. procesul va continua până când? Este logic să se presupună că, atâta timp cât oricare dintre reactanți este de peste. Cu toate acestea, în viața reală nu este așa. Faptul este că, după ce a început ceva timp după reacție, amoniacul format va fi descompus în azot și hidrogen, adică, va inversa reacție:
De fapt, într-un volum închis, va avea loc doar două, diametral opuse una alteia, reacția. Prin urmare, acest proces este înregistrat în această ecuație:
Săgeata dublă indică faptul că reacția merge în două direcții. Reacția compușilor cu azot și hidrogen numita reacție directă. Reacția de descompunere amoniac - reacție.
Chiar la începutul procesului de viteza de reacție înainte este foarte mare. Dar, cu concentrațiile de reactant în timp sunt reduse, iar cantitatea de amoniac crește - ca urmare a scade rata de reacție înainte, iar viteza invers - creșterea. Vine un moment în care viteza înainte și reacții inverse în comparație - vine echilibrul chimic sau echilibru dinamic. La echilibru curge, atât directe, cât și reacții inverse, dar vitezele lor sunt aceleași, astfel încât schimbarea nu este vizibil.
1. constanta de echilibru
Diferite reacții apar în mod diferit. În unele reacții până la apariția de echilibru se formează un număr destul de mare de produse de reacție; în altele - mult mai puțin. astfel putem spune că o anumită ecuație are propria sa constantă de echilibru. Cunoscând constanta de echilibru a reacției, se poate determina cantitatea relativă de reactanți și produși de reacție, în care are loc un echilibru chimic.
Fie o reacție descrisă de ecuația: aA + bB = cC + dD
- a, b, c, d - coeficienții ecuației reacției;
- A, B, C, D - formule chimice substanțe.
Parantezele indică faptul că participă la concentrația molară formula de substanțe.
Ce constanta de echilibru?
Mai mare constanta de echilibru (K), cu atât mai mare concentrația produșilor de reacție, care este instalat la echilibru
Pentru sinteza amoniacului, la temperatura camerei, R = 3,5 10 8 x este un număr destul de mare, ceea ce indică faptul că echilibrul chimic se produce atunci când concentrația amoniacului va fi mult mai materii prime rămase.
În producția reală de amoniac sarcină tehnolog este de a obține cel mai mare raport posibil echilibru, adică pentru a dirija reacția prin. Cum acest lucru poate fi realizat?
2. Principiul Le Chatelier
Statele principiu Le Chatelier lui: „Dacă un sistem este în echilibru, au un impact, ca urmare a proceselor soldului se va modifica în astfel de direcție, pentru a influența diminuarea“
Cum să înțeleagă acest lucru? Este foarte simplu. Supărat echilibrul în trei moduri:
- schimbarea concentrației substanței;
- modificarea temperaturii;
- prin schimbarea presiunii.
Atunci când reacția de sinteză a amoniacului este în echilibru, atunci acesta poate fi reprezentat după cum urmează (reacția este exotermă):
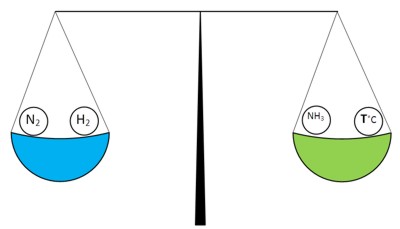
modifica concentrația
Introducem cantitatea suplimentară de azot într-un sistem echilibrat. Atunci când acest echilibru este perturbat:
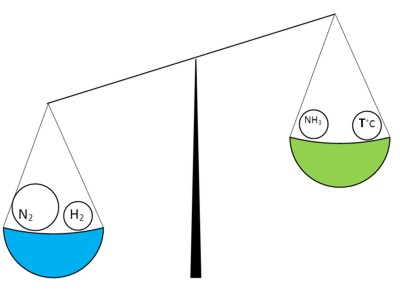
reacția directă începe să se producă mai rapid cu cât cantitatea de azot a crescut și reacționează în cantități mari. După ceva timp, din nou vin echilibrul chimic, dar concentrația de azot este mai mare decât concentrația de vodroda:
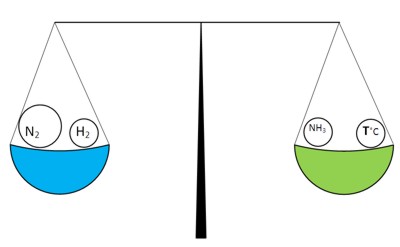
Cu toate acestea, pentru a pune în aplicare „inclinarea“ a sistemului poate fi în partea stângă și în alt fel - „relaxare“ pe partea dreapta, de exemplu, să ia amoniacul din sistem ca acesta este format. astfel va fi din nou dominat de reacția directă a formării de amoniac.
schimbările de temperatură
Partea dreaptă a „greutăți“ noastre poate fi variat prin schimbarea temperaturii. La stânga „mai importante decât“ nevoia de a „facilita“ partea dreapta - reduce temperatura:
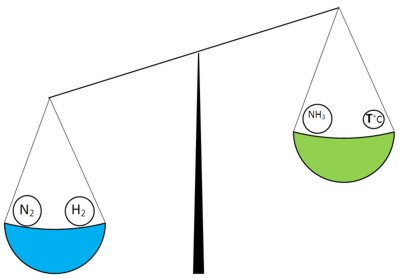
tensiunea mea
Afecta echilibrul sistemului cu o presiune numai în reacții cu gaze. Creșterea presiunii în două moduri:
- scăderea volumului de sistem;
- introducerea unui gaz inert.
Pe măsură ce presiunea crește numărul de coliziuni ale moleculelor crește. Acest lucru crește concentrația de gaze din sistem și schimba viteza înainte și înapoi reacțiile - echilibrul este perturbat. Pentru a restabili echilibrul sistemului „încearcă“, pentru a reduce presiunea.
In timpul sintezei amoniacului din 4 molecule de azot și hidrogen format două molecule de amoniac. Ca rezultat, numărul de molecule de gaz este redus - căderile de presiune. Ca urmare, pentru a ajunge la echilibru după rata de creștere a presiunii reacției crește înainte.
Pentru a rezuma. Conform principiului Le Chatelier de a crește producția de amoniac, puteți:
- creșterea concentrației reactanților;
- reducerea concentrației produșilor de reacție;
- reducerea temperaturii reacției;
- creșterea presiunii la care are loc reacția.