Fizica moleculara si Termodinamică
Grăitor, un proces adiabatic este descris în (p, V) - curbe diagrama similară cu izotermei (Figura 2.12.), Dar ajunge mai abruptă, deoarece g> 1. ca Cp> CV.
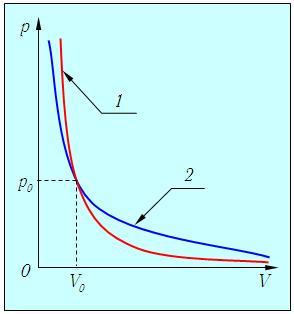
Fig. 2.12. proces adiabatic într-un gaz ideal: 1 - adiabatic, 2 - izotermă
Acest lucru este de înțeles, deoarece expansiunea adiabatică a gazelor efectuează muncă din cauza energiei interne și picături sale de temperatură, ceea ce reduce și mai mult presiunea în comparație cu expansiunea izoterma.
Studiul experimental al proceselor adiabatice într-un gaz ideal poate fi realizată folosind aparatul prezentat în fig. 2.13.
Fig. 2.13. Studiul experimental al proceselor adiabatice într-un gaz ideal
Având în vedere că din legea gazului ideal trebuie să fie proporțională
ecuația procesului adiabatic poate fi scrisă
Prima lege a termodinamicii aplicat la gazul de proces adiabatic permite operarea la expansiune adiabatică calculat:
Expresiile pentru un proces adiabatic atunci când se analizează Clapeyron - Mendeleev poate fi exprimată și temperatura la începutul și sfârșitul procesului
Exemplu. Amestecul de combustibil într-un motor diesel (vezi. Figura de mai sus) este aprins la o temperatură T2 = 1100 K. inițial Temperatura amestecului T1 = 350 K. Definim numărul de ori necesar pentru a reduce volumul amestecului în timpul comprimării, astfel încât acesta este aprins. Compresia va fi considerat adiabatic. index adiabatic pentru amestecul de g = 1,4.
Pentru a rezolva mai convenabil de a utiliza ecuația procesului adiabatic sub forma (2.31):
Rezultă imediat că expresia gradului de comprimare a amestecului combustibil: