Lecția - Sulf - substanță simplă
1) Ca 0 0 + Cl2 = Ca + 2 CI -1 compus 2 r-I
2) KCl + Br2 = p și nu t. A. Cl> Br
1) Ba 0 0 + F2 = Ba + 2F2 -1 compus pn
2) NaBr + I2 = p și nu t. Pentru a. Br> I
II. Lucrul pe tema lecției. Întrebări de studiu. dat pe ecran.
- Istoric Numele elementului
- Poziția atomului de sulf din sistemul periodic al elementelor chimice
- Proprietăți fizice. flotație
- modificări alotropice sulf
- Proprietățile chimice ale sulfului
- Sulf în natură
- Înțeles aplicare sulf.
1. Istoria elementului. Acum, este imposibil de a determina când o persoană este expusă mai întâi la sulf și compușii săi. Sa întâmplat cu mult timp în urmă. Ea a ajutat strămoșii noștri pentru a obține foc, mai degrabă scântei atunci când lovit de un fragment kresalom de pirită. Folositi-l pentru prepararea vopselelor și cosmetice. Ei au știut, și vechii indieni, care le-au dat numele - „sire“ - înseamnă „galben“. Simbolul chimic este derivat din cuvântul latin „Sulf“. Vechii romani numit sulf „bila zeu Vulcan“ (sfântul patron al focului). Pictura Karla Bryullova „Pompei“.
2. Se consideră situația unui element de sulf în tabelul elementelor chimice.
a. Scriem caracteristica elementului în notebook-uri - activitatea studenților din tabelul periodic al elementelor chimice, cu verificarea ulterioară a punerii în aplicare.
b. Elaborarea unui model de structură atomică cu poziția electronică - lucrarea este realizată pe o tablă magnetică.
în. Scriem e-mail și formula grafică.
a fost de a trage concluzii cu privire la stările de oxidare a elementului de sulf.
3. Proprietățile fizice ale unui sulf - substanță simplă.
Trebuie să saci de birouri, cu atenție rândul său, în jurul și uita-te la lucruri. Verificați relația cu apă - Se toarnă cu atenție conținutul pungii pe întreaga suprafață a apei, fără agitare (într-o carte de instruire - de referință 1). Formulăm concluzii din observații: sulf - un solid galben, în starea de bază a „plutește“ pe suprafața apei, în timp ce are o densitate mai mare decât apa.
„Flotația“ - (fr.) - Această proprietate se bazează pe diferite umectabilitatea de suprafață, în acest caz, apa și pudra de sulf este o metodă de îmbogățire a mineralelor.
Uita-te la comportamentul de sulf în raport cu alți solvenți - alcool. Nu este puțin solubilă. Demonstrarea de către profesori.
4. exemplu Sulf, ia în considerare din nou un fenomen natural - forme alotropice.
Există mai multe modificări cunoscute ale sulfului cu o structură moleculară ciclică sau liniară de compoziții diferite. Să considerăm cifrele: acestea sunt proiectate pe un ecran
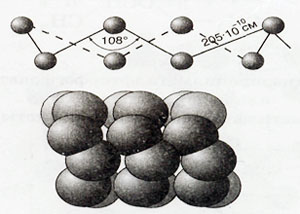
Structura moleculei S8 și structura modelului de sulf rombic
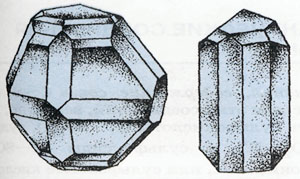
modificări cristaline de sulf:
Stânga - rombice. Dreapta - monoclinic
Sulf 3 modificări: romboidală, monoclinic și plastic. Din motive de sulf este o forme alotropice structură cristalină diferită de modificare a acesteia. Cel mai stabil - sulf rombic, în care molecula este format din 8 atomi în ciclu închis - S8.
Observăm experimentul. Se încălzește sulful sub formă de pulbere într-o flacără lampă spirit. Sulful lichid topit, într-un curent subțire, deversări ușor în paharul de apă rece. Obținem de sulf din plastic.
5. Luați în considerare proprietățile chimice ale sulfului - substanță simplă.
1. Arderea sulfului. Sunt în mâinile tuturor familiar obiect - o cutie de chibrituri. Aprinzi un chibrit. Mirosul - mirosul de gaz, care se formează în timpul arderii și se numește sulf - dioxid de sulf. Ecuația pentru această reacție:
S 0 = 0 + O2 S + 4O2 -2 Creează un cântar electronic.
H2 0 + S 0 = S H2 +1 -2 - hidrogen sulfurat gaz se formează substanțe otrăvitoare, ca urmare a cariilor compușilor organici. El este vorbit - mirosul de ou stricat de hidrogen sulfurat.
3. Reacția sulfului cu metale - formarea sulfurilor:
a. Na + 0 S 0 = Na2 +1 S -2. Pentru această ecuație pentru a face un cântar electronic.
b. Hg 0 + S 0 = S Hg +2 -2. Această reacție este de o importanță practică. Procesul se numește - demercurization - îndepărtarea și neutralizarea mercurului vărsat.
Pentru a rezuma, sulful în reacțiile cu oxigenul și metale prezintă diferite grade de oxidare +4 și -2.Yavlyayas agent reducător și agent de oxidare.
Pentru a consolida. ecuațiilor de reacții de sulf cu aluminiu și zinc.
5. Sulf în natură. Acum, un pic de odihnă, să ne „extracția de sulf.“ Ai în mâinile unui dispozitiv prietenos și familiar - tampoane de bumbac. În cazul în care în corpul de sulf și de ce avem nevoie de ea? Asta-i drept, de la produsele alimentare. Iată câteva dintre ele: mazăre, ouă, fulgi de ovăz. Discutați cu elevii întrebarea.
Du-te pentru a lucra cu notițe. Faceți cunoștință cu mostre de minerale naturale care conțin sulf.
Independent de lucru cu imaginile și tabelul de distribuire a manual 8 la pagina 98 (în carte de instruire - 2) de condițiile de lucru. Pentru studenții primesc mostre de sulf nativ și compușii săi sulfide și sulfat: pirită, galenă, calcopirită, gips.
6. Utilizarea și rolul sulfului. O invenție a omenirii cu sulf, ați văzut azi - este un meci. Și acum, uita-te la acest design - oală, care conține trei componente, piatra de top. Și este relevant pentru subiectul nostru, povestea spune că a determinat de supraveghere și, desigur, o persoană competentă pentru inventarea de arme.
aplicarea de sulf sunt diverse, veți învăța despre pregătirea temelor. Vom discuta acest lucru în lecția următoare.
Pentru a rezuma lecția noastră. Introducerea - gri - vă oferă o mulțime de lucruri noi si interesante. Ne-am consolidat abilitățile existente. Vă doresc succes munca la domiciliu pe instrucțiunile.
Tema. Revendicați 21 upr.3.4 p.99. Găsiți răspunsul la întrebarea: de ce în urechi de sulf?
Completați oricare dintre propunerile sugerate:
- Cele mai interesante din clasa pentru mine a fost ....
- Cel mai neinteresante din clasa pentru mine a fost ....
- Am învățat ....
- Acum, doriți să aflați mai multe ....
- Mi-a placut ....
- Aș dori să vă spun ....
- A fost cea mai plictisitoare în lecție.
- O să amintesc ....
1 sarcină. extinde cu grijă punga cu gri. Luați în considerare semnele exterioare ale substanței: stare fizică, culoare; Apoi, turnat cu grijă pe suprafața apei în pahar. Nu interveniți! Trage concluzii cu privire la relația de apă de sulf (densitatea sa, solubilitatea).
2 atribuire. Luați în considerare exemple de minerale naturale care conțin sulf. Folosind tabelul 8 de la pagina 98 a manualului, scrie într-un caiet numele și formula de minerale.