Nivelurile de organizare a moleculelor proteice
Nativ, statul (o stare în care proteinele efectuează lor biologică funcția) moleculă de proteină are o structură spațială caracteristică pentru ea (conformație).
În funcție de conformație, adică lanț polipeptidic locație caracter în spațiu, sau cu alte cuvinte, forma moleculelor, proteinele pot fi împărțite în două grupe mari -fibrillyarnye și globulare. lanțuri polipeptidice de proteine fibrilare sunt paralele între ele de-a lungul aceleiași axe, formând lungi filamentare cu fibre - fibrile. Acestea sunt principalele elemente structurale ale țesutului conjunctiv și osos, colagen, tendoane, formațiuni corn, pielea, unghiile, pene, păr. Aceste substanțe stabile, care sunt insolubile în apă și se diluează soluții de sare.
Proteinele globulare sunt caracterizate printr-o structură sferică sau globulară, lanțuri polipeptidice sunt îndoite într-o formație compactă care seamănă cu forma bilă (globulelor). Astfel de proteine din organism mult mai mult decât fibrilară. Acestea includ aproape toate enzimele și anticorpii cunoscuți în prezent, unii hormoni și proteine care îndeplinesc funcția de transport (hemoglobina, albumina serică, etc.). Cele mai multe proteine globulare sunt solubile în apă și este ușor difuză.
Unele proteine sunt intermediare. Ca fibrilare, ele constau din structuri filamentare, în același timp, similar cu proteinele globulare sunt solubile în soluții apoase de sare.
Pentru a indica diferitele niveluri ale structurii moleculei de proteină sunt concepte ale structurilor primare, secundare, terțiare și cuaternare.
Structura primară caracterizează o compoziție de calitate de aminoacizi a lanțului polipeptidic, numărul de resturi de aminoacizi în ea legați prin legături peptidice, precum și ordinea de succesiune a acestor reziduuri. Această structură oferă o idee de a plasa o moleculă de proteină în plan.
Cu toate acestea, structura proteinei primară a cunoașterii nu este suficient pentru a reprezenta structura completă. De fapt, molecula de proteină nu se află în același plan.
Secundar Structura - forma lanțului proteic, o metodă de plasare a acesteia în spațiul - în mare măsură determinată de condițiile de mediu în care proteina și proprietățile specifice și structura legăturii peptidice.
Studiind proteine fibrilare, R. L. Pauling și Corey au stabilit parametrii de bază ai legăturii peptidice unde au indicat că distanța dintre atomii de carbon și azot (adică, lungimea legăturilor peptidice) este 0,132 nm. Această valoare este media dintre valorile lungimii unei singure convențional C-C (0154 nm) și un dublu> C = O (0.123 nm) obligațiuni. Prin urmare, legătura peptidică este similară în natură cu dublul și se rotească liber pe imposibilă. Patru atomi de legătură peptidică (O, C, N, H) și două # 945 atom de carbon situat într-un plan, și atomii de oxigen și hidrogen - în poziția trans față de legătura peptidică. În plus, acesta a fost măsurat, de asemenea, unghiuri între atomii individuali (Fig. 25).
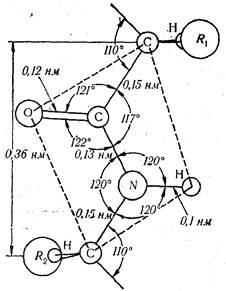
Folosind datele obținute pe structura legăturii peptidice, R. L. Pauling și modelul Corey construit peptide scurte și a concluzionat că lanțul polipeptidic este o lungă serie de avioane, separate # 945 atomi de carbon, sau metilen poduri. În acest sens, structura primară a moleculei de proteină poate fi reprezentată mai precis ca un lanț lung constând dintr-un număr mare de avioane peptidice legături care leagă aminoacizii corespunzători radicalilor la anumite unghiuri.
Stabilit posibilitatea unui spot de rotație, Pauling și Corey a ajuns la o altă concluzie importantă - cea mai simplă structură spațială a lanțului peptidic este o spirală. În structura numită # 945; helix și caracteristică # 945; Unitatea -keratinov se repetă periodic, este o bobină (Fig. 26). Este nevoie de-a lungul axei de aproximativ 0,54 nm și o perioadă lungă de timp este numit helix. La un viraj pentru reziduuri de acid 3,6 aminoacizi. Un astfel de reziduu ocupă 0,15 nm și reprezintă o perioadă mică # 945; helix. aceasta # 945 structura elicoidală a lanțului peptidic permite formarea de legături de hidrogen intercatenare între spirele helix. Se constată că acestea sunt formate între atomii de hidrogen legați la un atom de azot al electronegativ o legătură peptidică, și al patrulea grup rest carbonil atom de oxigen lui. In plus, fiecare lanț de legătură peptidică este implicată în formarea de legături de hidrogen (primul la al patrulea, al doilea la al cincilea, al treilea la al șaselea, și așa mai departe), astfel încât întregul sistem cât mai mult posibil completă a acestor legături.
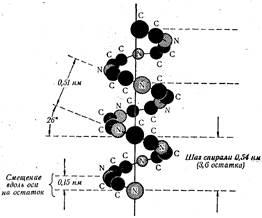
Există și alte modalități de ambalare lanțuri de peptide elicoidale, dar # 945 configurație elicoidală este cel mai stabil. Se presupune că o astfel de formă lanțuri peptidice ia arbitrară, deoarece are energie cel mai puțin liberă.
Este bine stabilit faptul ca proteinele fibrilare legată de # 945; -keratinam (păr, lână, formarea corn, cuie, piele, pene, etc.), este format dintr-o lanțuri de peptide paralele având # 945; configurație elicoidală. Trebuie subliniat faptul că angajamentul față de formarea unui grajd # 945; helix este determinată de natura și secvența resturilor de aminoacizi din catena și este dependentă de pH.
Ei bine cercetat și o altă formă de plasare a lanțului peptidic în spațiu. Acesta este numit # 946 conformație și are o formă alungită în zig-zag (Figura 27.). Paralel situat în lanțul # 946; -conformation, sunt interconectate prin legături de hidrogen intercatenare transversal și formează o structură stratificată coli. In reticulare, precum și în # 945; helix, implică toate legăturile peptidice, dând structura o stabilitate ridicată. Structura strat pliat tip seamănă cu un întins # 945; helix și este caracteristică proteinelor # 946; -keratinov. Un exemplu al unei astfel de proteine poate fi fibroină fire din care constau din mătase.
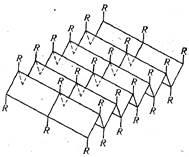
Astfel, structura secundară a moleculei de proteină - un lanț peptidic astfel configurație într-un spațiu, care este o formă de spirală sau o structură stratificată coli. Structura secundară este cea mai înaltă formă de organizare pentru proteine fibrilare.
Structura de proteine spiral sau secundare pot fi plasate în mod diferit într-un anumit volum. Metodă de stabilire a unei structuri secundare pentru a forma spire de diferite forme sunt numite structura terțiară. Acest nivel mai ridicat de organizare a moleculelor de proteine tipice pentru proteine globulare. Structura terțiară este destul de complex, iar studiul său prezintă anumite dificultăți. Prin urmare, în prezent, această structură a fost bine studiat pentru unele proteine.
Un rol important în formarea de structuri terțiare joace un legături de hidrogen și disulfidice, contribuind la crearea sa, precum și disponibilitatea punctelor instabile locale la care # 945; helix poate fi îndoit. De regulă, în locurile peptidei se găsesc resturile coturile de lanț de prolină, precum și aminoacizi, care nu sunt în măsură să formeze cu ușurință # 945-elicoidale structura, cum ar fi izoleucina sau serii și catene laterale de aminoacizi care la pH 7 au taxe egale. Radicali astfel de acizi, împingând în afară încalcă lanț spiralization de ce în aceste lanț de locuri de peptidă este ușor îndoit. Se crede că structura terțiară are loc în mod automat, ca rezultat al interacțiunii dintre resturile de aminoacizi cu molecule de solvent. Radicalii Astfel hidrofobe „tras“ în molecula de proteină, iar grupările hidrofile sunt orientate către solvent. Astfel, o moleculă de proteină compact format în care substanțial nu conține molecule de apă. Acest lucru duce la crearea conformație energetice favorabile a moleculei de proteină.
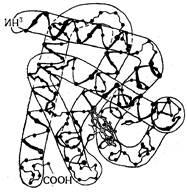
O structură de proteină tridimensională bine studiate este mioglobina. Studiile efectuate de J. Kendrew și colaboratorii au arătat că molecula mioglobina constă dintr-un lanț peptidic singur, răsucite într-o spirală. În locurile de curbe, în cazul în care helix lipsește, este pralină. mioglobina lanțul peptidic ca un „cârnat“ lung, bizar (Fig. 28). O astfel de structură specifică, care rezultă din răsucirea și îndoire, și se numește structura terțiară a mioglobinei.
Un nivel superior de organizare a moleculei de proteină este o structură cuaternară. Ea apare ca rezultat al asocierii mai multor lanțuri de peptide având structura primară, secundară și terțiară. Cu alte cuvinte, acest nivel de organizare este unirea mai multor lanțuri de peptide cu structura terțiară a unei singure molecule mari (fig. 29), în care greutatea moleculară depășește 50000. Astfel de proteine sunt numite oligomeri. Fiecare lanț peptidic, o parte a unei proteine de protomer oligomerică este cunoscută care fuzionează pentru a forma o subunitate. Acest termen se referă la o porțiune funcțională activă a unei proteine oligomeric. Astfel, structura caracteristică cuaternară a proteinelor oligomerice.
Un exemplu clasic al unui oligomer sau o structură de proteină cuaternară este hemoglobină. Porțiunea de proteină din moleculele sale, numite protomers globinei este format din patru - doua identice # 945; -chains și două identice # 946; -chains; # 945; - și # 946; - lanț care unește împreună în perechi, pentru a forma două perechi de subunități, care pot disociază molecula de hemoglobina (Figura 30.).
Fig. 30. Circuitul molecula de hemoglobină de disociere în două subunități.
Astfel, molecula de hemoglobina este compus din patru lanțuri de peptide, care sunt strâns ambalate împreună și formează o singură structură globulară. Între lanțurile individuale au legături covalente puternice, cu toate acestea, întreaga moleculă are o mare stabilitate.
Sa constatat că, prin structura sa terțiară # 945; - și # 946; sunt foarte asemănătoare cu catenă cu configurația terțiară a unui lanț mioglobinei singur. Acest lucru sugerează că o funcție biologică similară a acestor două proteine este capacitatea lor de a se lega reversibil de oxigen, datorită similarității structurii lor terțiare a lanțurilor peptidice. In concluzie, trebuie subliniat din nou faptul că structura secundară, terțiară și cuaternară a moleculelor de proteină definită prin secvența de aminoacizi a lanțului peptidic, adică, Structura primară. În plus, configurația lanțului de peptide, de asemenea, determinată de mărimea, forma și aminoacizi R grupe ordinea aranjament.
Pentru fiecare proteină caracterizată prin cel puțin o structură tridimensională, care este stabilă și prezintă o activitate biologică în condiții fiziologice (temperatura, pH). Această structură este numită conformația nativă a proteinei.