proces adiabatic - studopediya
Principalii parametri ce caracterizează starea presiunii gazului P. este volumul V și temperatura T. Relația dintre acești parametri pentru idealul set ecuația Mendeleev-Clapeyron:
unde M - masa unui mol de gaz, kg / mol; m - masa de gaz, kg; T - temperatura absolută a gazului, K; R = 8,31 J / (mol x K), - constanta universală (molar) de gaz.
Dacă există două din cele trei parametrii de bază ai gazului, al treilea poate fi exprimat prin ele. La schimbarea cei trei parametri ai parametrilor inițiali de gaz (p1. V1. T1) asociate cu noii parametri de aceeași cantitate de gaz (p2. V2. T2) ecuație.
Adiabatică un proces care pe proces are loc fără schimb de căldură cu mediul înconjurător. și anume Q = 0.
proces adiabatic poate fi efectuată în sistem, înconjurat de un (adiabatic) cochilie termoizolatoare. Un exemplu al acestui proces - ciclul de lucru al motorului termic, în care gazul (aburul) în cilindrul se extinde cu pereți izolanți și pistonul, în absența unor transformări ireversibile ale activității de frecare în căldură. proces adiabatic poate fi pus în aplicare în absența shell adiabatic; pentru aceasta el trebuie să procedeze atât de repede încât în timpul procesului de transfer de căldură a avut loc între sistem și mediul înconjurător.
Prima lege a termodinamicii este:
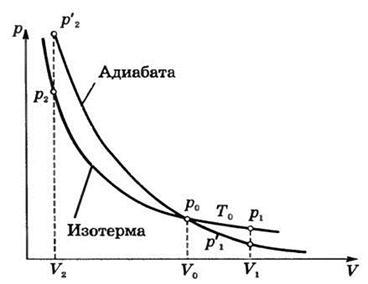
Acest lucru înseamnă că, atunci când un proces adiabatic, sistemul poate efectua munca pe organisme externe numai prin pierderea energiei sale interne. Dacă A> 0, # 916; U = -A <0, т.е. U2 După cum se știe, gaz efectuează muncă în cazul în care # 916; V> 0. Astfel, atunci când gazul de expansiune adiabatică efectuează lucrarea în sine este răcit. Invers, dacă o comprimare adiabatică (A <0 ) над газом совершается работа и газ нагревается . Când presiunea de proces adiabatic și volum sunt legate de ecuația: p × V g = const sau p × T g / (g - 1) = const, unde # 947> 1 - raportul căldurilor specifice (sau raportul Poisson). Această ecuație se numește ecuația adiabatică sau ecuația Poisson. S schimbare de entropie a sistemului într-un proces adiabatic reversibil datorită transferului de căldură prin Granițele sistemului nu are loc: Acolo unde T - temperatura sistemului, # 948; Q - căldura primită de către sistem. Datorită acestui proces adiabatică poate face parte dintr-un ciclu reversibil. schimbarea adiabatică de stare a gazului poate fi exprimată grafic. Graficul acestui proces este numit adiabatic (Fig. 2). În cazul în aceleași condiții inițiale (p0. V0) scade mai rapid la expansiunea adiabatică a presiunii gazului decât sub izotermă, deoarece căderea de presiune cauzată nu numai de o creștere a volumului (ca într-o expansiune izotermă), dar, de asemenea, o scădere a temperaturii. Prin urmare, merge mai jos de gaz adiabatică și izotermă la expansiunea adiabatică nu mai puțin de lucru decât în expansiune izotermă.
Cu compresie rapidă (expansiune) de căldură nu are timp să aibă loc și procese pot fi considerate ca fiind adiabatică (neechilibru). Prin urmare, orice gaz este încălzit prin compresie rapidă (de exemplu, pompa de căldură când umflarea roților de bicicletă). Dacă o temperatură puternică și rapidă de compresie poate crește, astfel încât, în prezența vaporilor de benzină în aer sunt aprinse. Acest lucru este utilizat în motoarele diesel pentru aprinderea amestecului combustibil. Acest lucru explică necesitatea unei răciri dedicat compresoare puternice.
Răcire cu aer sub expansiune adiabatică determină formarea de nori.