Structura Atom din nucleul unui atom, neutroni, protoni, electroni,
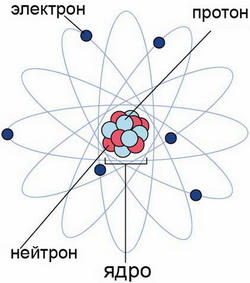
Atom - cea mai mică particulă a unui element chimic, care păstrează toate proprietățile chimice ale acesteia. Atom constă dintr-un miez având o sarcină electrică pozitivă, iar electronii încărcați negativ. Acuzația nucleului oricărui element chimic este egal cu produsul dintre Z e, unde Z - numărul de ordine al elementului în sistemul periodic al elementelor chimice, e - cantitatea de sarcină electrică elementară.
substanță de particule minut, cu o sarcină electrică negativă e = 1,6 × 10 -19 Coulomb luat ca o sarcina electrica elementara - Electronic. Electronii se rotesc in jurul nucleului, sunt aranjate pe coji de electroni K, L, M și K, etc - .. tecii cel mai apropiat de miez. Dimensiunea atom este determinată de mărimea cochiliei de electroni. Atom pot pierde electroni și să devină un ion pozitiv sau atașați electroni și devin ioni negativi. taxa Ion determină numărul de electroni pierdute sau asociate. Procesul de conversie a atomilor neutri în ionul încărcat se numește ionizare.
Nucleul atomic (atom central) este format din particule nucleare elementare - protoni și neutroni. Raza de bază de aproximativ o sută de mii de ori mai mică decât raza atomului. Densitatea nucleului atomic este extrem de mare. Protonii - particule elementare stabile având o sarcină pozitivă unică și de masă, este de 1836 de ori mai mare decât masa electronului. Proton reprezintă nucleul unui atom al celor mai ușoare elemente - hidrogen. Numărul de protoni din nucleu este egal cu Z. Neutronul - neutru (nu are sarcină electrică) particulă elementară cu o masă foarte apropiată de cea a protonului. Deoarece masa de bază este format din masa de protoni și neutroni, atunci numărul de neutroni în nucleul unui atom este egal cu A - Z, în care A - (. Vezi tabelul periodic al elementelor) numărul de masă al izotopului. Protonul și un neutron, o parte a nucleului, sunt numite nucleoni. La baza nucleoni legat forțelor nucleare speciale.
Nucleul atomic are o rezervă foarte mare de energie, care este eliberată în timpul reacțiilor nucleare. Reacțiile nucleare apar în interacțiunea nucleelor atomice sau a particulelor elementare cu nucleele altor elemente. Ca urmare a reacțiilor nucleare, se formează noi nuclee. De exemplu, neutroni poate trece un proton. În acest caz, miezul este expulzat din particule beta, adică. E. Electron.
Trecerea la nucleul de protoni in neutroni poate fi realizată în două moduri: fie din miezul particulelor emise cu o masă egală cu masa electronului, dar cu o sarcină pozitivă, numită pozitron (pozitron descompunere), sau nucleu captează un electron de la cel mai apropiat la acesta de K-shell (K Capture).
Uneori, miezul rezultat are un exces de energie (stocată într-o stare excitată) și, trecând la starea normală, alocă energia în exces sub formă de radiație electromagnetică cu o lungime de undă foarte scurtă - radiații gamma. Energia eliberată în reacțiile nucleare, este utilizat, practic, în diverse industrii.
Atom (Atomos greacă -. Indivizibilă) cea mai mică particulă a unui element chimic, având proprietățile sale chimice. Fiecare element este format din atomi ai unei anumite specii. Structura include un atom de bază care poartă o sarcină electrică pozitivă, iar electronii încărcați negativ (cm.) Formarea cochilia de electroni. Cantitatea de sarcină electrică a nucleului este Ze, unde e - sarcină electrică elementară egală ca mărime cu încărcătura de electroni (4,8 x 10 -10 el.-st. u) și Z - numărul atomic al elementului în sistemul periodic al elementelor chimice (a se vedea ) .. Deoarece atom neîncărcată neutru, numărul de electroni care intră în ea, este de asemenea egal cu Z. Structura nucleului (Cm nucleu atomic.) Nucleoni sunt particule elementare cu o masă de aproximativ 1840 de ori masa de electroni (egal cu 9,1 x 10 - 28 g), protoni (cm.), încărcată pozitiv și neutroni neîncărcate (cm.). Numărul de nucleoni din nucleu se numește numărul de masă și este notat cu litera A. Numărul de protoni din nucleu egal cu Z, care determină numărul de electroni de intrare în atom, structura coajă de electroni și proprietățile chimice ale atomului. Numărul de neutroni din nucleu este egal cu A-Z. numita izotopic specii de același element A care diferă unul de altul printr-un număr O masă, dar au aceeași Z. Astfel, în A. nuclee de izotopi diferite ale unui element are un număr diferit de neutroni, cu același număr de protoni. Atunci când marcarea izotop numărul de masă A este scris deasupra simbolului elementului și numărul atomic în partea de jos; de exemplu, izotopi de oxigen sunt indicate:
Dimensiuni determinate de dimensiunile cojile de electroni atom și constituie toate Z de ordinul 10 -8 cm. Deoarece masa electronilor A. câteva mii de ori mai mică decât greutatea miezului, A. masa proporțională cu numărul de masă. Greutatea relativă atom dat izotop definit în raport cu greutatea izotopului de carbon A. C. 12. a primit 12 unități numite masa izotopică. Este aproape de numărul de masă al izotopului corespunzător. Ponderea relativă a elementului chimic A reprezintă media (ținând cont de abundența relativă a izotopilor elementului), valoarea greutății izotopice și se numește greutatea atomică (masă).
Un atom este un sistem microscopic, iar structura și proprietățile sale pot fi explicate numai în termenii teoriei cuantice dezvoltate in principal in anii 20 ai secolului 20 și are rolul de a descrie fenomenele la scara atomica. Experimentele au demonstrat că microparticulele - electroni, protoni, atomi etc., - .. corpuscular în plus, au proprietăți de undă manifestate în difracție și interferențe. În teoria cuantică pentru a descrie starea obiectelor microscopice folosind un câmp val, care se caracterizează prin funcția de undă (Ψ-funcție). Această funcție determină probabilitățile de stări posibile ale unui obiect microscopic, t. E. Caracterizează manifestările potențiale ale unora dintre proprietățile sale. modificări a legii în funcția Ψ în spațiu și timp (ecuația Schrödinger), care permite de a găsi această funcție joacă în teoria cuantică, același rol pe care în mecanica clasică legile mișcării ale lui Newton. ecuația Schrödinger, în multe cazuri, duce la stările posibile ale unui sistem discret. De exemplu, în cazul numărului atomului de rotații ale funcțiilor de undă ale electronilor care corespund diferitelor valori (cuantizate) de energie. Un sistem de niveluri de energie calculat prin teoria cuantică, a primit o confirmare strălucită în spectroscopie. Tranziția de la atomii de stat la sol corespunzătoare la cel mai scăzut nivel de energie E0. în oricare dintre stările excitate Ei se produce la absorbția unei cantități specifice de energie Ei - E0. A. Excited continuă într-o stare mai puțin excitat sau la sol cu emisie de foton normal. În acest caz, energia fotonilor este HV diferența de energie între două stări în atom: hv = Ei - EC unde h - constanta lui Planck (6,62 x 10 -27 erg sec), v - viteza luminii.
În plus față de spectrele atomice, teoria cuantică a făcut posibilă pentru a explica și alte proprietăți ale A. În particular, valența au fost explicate, natura bonding chimice si structura moleculelor, o teorie a sistemului periodic al elementelor.