Structura atomului
Atom (din Atomos greacă - indivizibil) - un singur nucleu chimic indivizibil element chimic particule, proprietățile purtătoare ale substanței. Substanțele constau din atomi. Atom în sine constă dintr-un nucleu încărcat pozitiv și electroni nor încărcat negativ. In general atom este electric neutru. atom Mărimea este complet determinată de mărimea norului său de electroni deoarece dimensiunea nucleu este neglijabilă comparativ cu dimensiunea norului de electroni. Z nucleu format din protoni încărcați pozitiv (taxa de protoni corespunde la +1 în unități arbitrare) și N neutroni care nu poartă o sarcină (protoni și neutroni numite nucleoni). Astfel, sarcina nucleară determinată numai de numărul de protoni și este egal cu numărul ordinal al elementului din tabelul periodic. Sarcina pozitiva este compensata nucleu electroni încărcați negativ (încărcare de electroni -1 unități arbitrare), care formează un nor de electroni. Numărul de electroni egal cu numărul de protoni. Greutățile de protoni și neutroni sunt (respectiv 1 și 1 uam). masa atomică determinată de masa nucleului său, deoarece masa de electroni este de aproximativ 1850 de ori mai mică decât masa unui proton și un neutron și în calcule sunt rareori luate în considerare. Numărul de neutroni poate fi găsit din diferența dintre masa atomului și numărul de protoni (N = A -Z). Tipul de atomi ai unui element chimic cu un miez constând dintr-un număr strict definit de protoni (Z) și neutroni (N) se numește nuclid.
taxa (unități arbitrare)
Deoarece nucleul atomului este concentrată aproape întreaga masă, dar dimensiunea sa este neglijabilă în comparație cu volumul total al atomului, materialul de miez se consideră în mod convențional punct staționar în centrul atomului, iar atomul este privit ca un sistem de electroni. Atunci când reacția chimică nu este afectată de nucleul atomic (cu excepția reacțiilor nucleare) ca nivelurile de electroni intern și implică numai învelișul de electroni exterior al electronilor. Din acest motiv, este necesar să se cunoască proprietățile electronului și regulile de formare a cochilii de electroni de atomi.
Înainte de a studia proprietățile electronice și regulile de formare a nivelurilor de electroni, este necesar să se abordeze istoria formării de idei despre structura atomului. Noi nu va acoperi întreaga istorie a formării structurii atomice, și să se concentreze doar pe cele mai urgente și cele mai multe reprezentări „adevărate“ care pot arăta cel mai clar modul în care electronii sunt aranjate în atom. Primii atomi de disponibilitate ca un material constitutiv de bază și-a asumat filozofia greacă. După aceea, istoria structurii atomice a trecut o cale complicată și idei diferite, cum ar fi indivizibilitatea atomului, modelul Thomson al atomului, și altele. Cel mai apropiat model al atomului a fost propus de Ernest Rutherford în 1911. El atom de comparat cu sistemul solar, unde solar a acționat ca atomul de bază, iar electronii se misca precum planetele din jurul ei. plasarea de electroni pe orbită staționară a fost un pas foarte important în înțelegerea structurii atomului. Cu toate acestea, un astfel de model planetar al structurii atomice a fost în contradicție cu mecanica clasică. Faptul că mișcarea unui electron în orbita a trebuit să-și piardă potențialul de energie și în cele din urmă „cad“ în nucleu și atomul ar trebui să înceteze să mai existe. Acest paradox a fost eliminat prin introducerea postulatelor Niels Bohr. Conform acestor postulate de electroni se deplasează pe orbite în jurul unui miez de staționare și nu absorbită și energia emisă în condiții normale. Postulate arată că legile mecanicii clasice nu sunt adecvate pentru a descrie atomul. Un astfel de model este numit un model al atomului Bohr-Rutherford. Continuarea structurii planetare a atomului este un model mecanic cuantic al atomului, potrivit căruia vom considera un electron.
Un electron este o cvasi-particulă, care arată dualitatea undă-particulă. El este atât o particulă (corpuscul) și a valurilor. Pentru proprietăți includ masa particulelor de electroni și încărcătura, precum și la proprietățile undelor - capacitatea de a difracției și interferențe. Comunicarea între undă și particulă proprietățile electronilor reflectate în ecuația de Broglie:
Pentru un electron nu se poate calcula traiectoria sa, este posibil să vorbim doar despre probabilitatea de a găsi electronului în orice locație în jurul nucleului. Din acest motiv, nu vorbesc despre orbitele mișcarea electronilor în jurul nucleului, dar de orbitali - spațiul din jurul nucleului în care probabilitatea de a găsi electronului este mai mare de 95%. exact în același timp, este imposibil ca un electron pentru măsurarea poziției și vitezei (Heisenberg principiul incertitudinii).
unde Δ x - coordonata unei incertitudini de electroni, Δ v -pogreshnost de măsurare a vitezei, h = h / 2π = 1,05 · 10 -34 J · s
Cu cat Măsurăm de coordonate electronul, cu atât mai mare eroarea în măsurarea vitezei sale, și invers, cu mai multă precizie cunoaștem viteza electronului, cu atât mai mare incertitudinea în coordonarea sa.
Prezența proprietăților undelor electronului permite aplica ecuația undelor Schrodinger.
unde E - energia totală a electronului, V energia potențială a electronului, sensul fizic al funcției Ψ - rădăcina pătrată a probabilității de a găsi un electron în spațiu cu coordonate x. y și z (miezul este considerat originea).
Reprezentat prin ecuația scrisă pentru sistemul one electron. Pentru sistemele care conțin mai mult de un electron pentru a descrie principiul rămâne același, dar ecuația devine mai complicată. Soluție grafică a ecuației Schrodinger este geometria orbitali atomici. Din moment ce-s orbitală este o sferă, p-orbital - opt forma cu „nod“ la origine (pe miezul), unde probabilitatea de a găsi un electron tinde la zero.
În cadrul teoriei moderne mecanicii cuantice de electroni este descrisă printr-un set de numere cuantice: n. l. ml. s și ms. În conformitate cu principiul de excluziune la un singur atom nu poate fi doi electroni cu un set complet identice de numere cuantice.
Principalul cuantic numărul n determină nivelul de energie al electronului, care este, la ce nivel este electronul electronic. Numărul cuantic principal poate lua numai valori întregi mai mari decât 0: n = 1; 2; 3. Valoarea maximă a lui n pentru un atom element specific corespunde numărului perioadei în care elementul se află în tabelul periodic al lui Mendeleev.
Orbital (opțional) numărul cuantic l determină geometria norului de electroni. Se poate lua valori întregi de la 0 la n-1. Pentru valori ale denumirii numărul cuantic l litere suplimentare utilizate:

orbitali de tip la diferite nivele de energie (pentru diferite n)
Electronii orbitali și nivelurile nu sunt plasate la întâmplare, ci prin regula Klechkovskii. prin care electronii de umplere are loc în conformitate cu principiul energiei minime, adică în ordinea creșterii sumei principalului și a numerelor cuantice orbitale n + l. În cazul în care cantitatea de umplere pentru cele două variante ale aceluiași, inițial umplut cu cel mai scăzut nivel de energie (de exemplu, când n = 3 și l = 2 și n = 4 și l = 1 este inițial umplut va fi nivelul 3). Magnetic cuantic număr ml definește locația orbitală în spațiu și poate lua o valoare întreagă de la -l la + l inclusiv 0 s-orbitali, eventual doar o singură valoare ml = 0. Pentru p-orbitali a trei valori -1, 0 și +1, adică p-orbital poate fi dispusă de-a lungul trei axe de coordonate x, y și z.
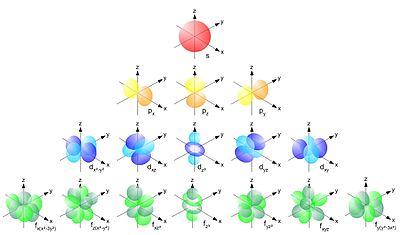
locația orbitalii, în funcție de valoarea de ml
Electronic are propriul impuls unghiular - de spin numărul cuantic este notat s. electron de spin - constantă și egală cu 1/2. Fenomenul din spate poate fi reprezentat în mod convențional ca o mișcare în jurul propriei sale axe. Inițial, spinul electronului este echivalat cu mișcarea planetei în jurul axei sale, dar o astfel de comparație este greșită. Spin - un fenomen pur cuantic, care nu are analogii în mecanica clasică.