Sulphur - este
SULF
S (sulf),
element chimic nemetalic, membru al familiei calcogen (O, S, Se, Te și Po) - IVA a tabelului periodic al sistemului subgrupului. Cera, precum și multe dintre aplicațiile sale, sunt cunoscute inca din cele mai vechi timpuri. Lavoisier a susținut că sulf - un element. Sulful este vitală pentru creșterea plantelor și animalelor, aceasta este o parte a organismelor vii și a produselor lor de descompunere, de o mulțime de, de exemplu, ouă, varză, hrean, usturoi, muștar, ceapă, păr, lână, etc. De asemenea, este prezent în cărbune și petrol.
Aplicație. Aproximativ jumatate din consumul anual de sulf este producerea de substanțe chimice industriale cum ar fi acidul sulfuric, dioxid de sulf și disulfură de carbon (sulfura de carbon). În plus, sulful este utilizat pe scară largă în fabricarea de insecticide, chibrituri, îngrășăminte, explozivi, hârtie, polimeri, vopsele și coloranți pentru vulcanizarea cauciucului. Poziția de lider în producția de sulf sunt Statele Unite, țările CSI și Canada.
Prevalența în natură. Sulful se găsește în stare liberă (pucioasă). În plus, există rezerve uriașe de sulf ca zăcămintele de sulfuri, plumb în special minereuri (galena), zinc (blendă zinc), cupru (cupru sheen) și fier (pirita). La scoaterea metalului din minereu, de obicei, sunt eliberate de sulf în prezența oxigenului ardere, formând astfel un dioxid de sulf (IV), care este adesea emisă în atmosferă fără a fi utilizate. De asemenea, destul de multe minereuri sulfuroase de sulf constatat ca sulfat, cum ar fi sulfatul de calciu (gips), sulfat de bariu (baritină). In apa de mare si multe ape minerale prezente în sulfați de magneziu și sodiu solubili în apă. In unele ape minerale se produce hidrogen sulfurat (hidrogen sulfurat). In industrie, sulful poate fi produsă ca produs secundar în procesele de topire, cuptoare de cocs, cu rafinare, naturale sau din gazele de ardere. Din zăcămintele subterane naturale de extract de sulf, topirea și se livrează apă supraîncălzită la suprafață cu aer comprimat și pompe. În recuperarea Frasch-proces de sulf din depozite care conțin sulf în instalație sub formă de tuburi concentrice G.Frashem brevetat în 1891, obținut cu o puritate de sulf la 99,5%.
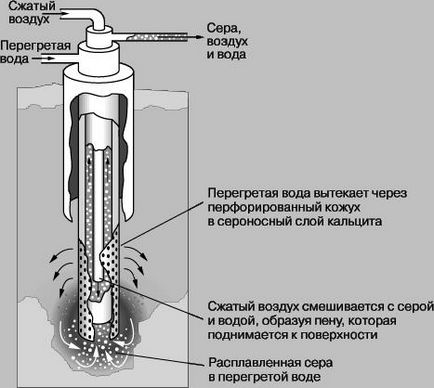
proces Frasch pentru a extrage sulf natural din zăcămintele subterane.
Proprietăți. Sulful are forma unei pulberi cristaline de culoare galbenă sau masă casant este inodor și fără gust și insolubil în apă. Sulful caracterizat prin câteva modificări alotropice. Cele mai cunoscute sunt următoarele: sulf cristalin - ortorombică (pucioasă, o-S) și monoclinice (sulf prismatic, b-S); amorf - coloid (lapte de sulf) și din material plastic; intermediar amorf-cristalin - sublimat (flori de sulf). PROPRIETĂȚI SULPHUR
Numărul atomic 16 masă atomică 32,066 Izotopi
stabil 32, 33, 34, 36
instabil 31, 35, 37
Cea mai mare parte a acidului obținut este utilizat pentru a produce îngrășăminte (superfosfat, sulfat de amoniu). Acidul sulfuric este materia primă pentru prepararea sărurilor și altor acizi pentru sinteza de substanțe organice, fibre sintetice, pentru curățarea cu kerosen, uleiuri de petrol, benzen, tolouola, în fabricarea vopselelor, corodare a metalelor feroase, hidrometalurgie uraniu și unele metale neferoase, pentru spălare și medicamente, ca un electrolit din acumulatorii cu plumb și ca desicant. Acid tiosulfuric H2S2O3, acid sulfuric structural analog cu excepția înlocuirii unui oxigen printr-un atom de sulf. Derivatul de acid cel mai important este Na2S2O3 tiosulfat de sodiu - cristale incolore formate în timpul de fierbere Na2SO3 culoare sulfit de sodiu sulf. Tiosulfat (sau hipo) sodiu utilizat în fotografie ca fixator (fixator). Sulfonal (CH3) 2C (SO2C2H5) 2 - solid alb cristalin, este inodor, slab solubil în apă, este un medicament și este folosit ca un sedativ și hipnotic. H2S de hidrogen sulfurat (hidrogen sulfurat) - gaz incolor, cu miros neplăcut înțepător de ouă stricate. Este oarecum mai greu decât aerul (densitate 1.189 g / dm3), ușor de lichefiat într-un lichid incolor și este ușor solubil în apă. Soluția în apă este un acid slab cu pH SERA 4. lichid hidrogen sulfurat este utilizat ca solvent. Soluția și gazul este utilizat pe scară largă în analiza calitativă pentru separarea și determinarea multor metale. Respiratia mici cantități de hidrogen sulfurat cauzează dureri de cap și greață, cantități mari sau inhalarea continuă a hidrogenului sulfurat cauza paralizie a sistemului nervos, inima și plămânii. Paralizia apare brusc, ca urmare a unor încălcări ale funcțiilor vitale. Sulf monoclorură, S2Cl2 - fumans chihlimbar lichid uleios, cu un miros înțepător, lacrimogen și împiedică respirația. Ea fum în aerul umed și descompus de apă, dar solubilă în disulfură de carbon. Sulful monoclorură - solvent bun pentru sulf, iod, halogenuri de metale și compuși organici. Monoclorură este utilizat pentru vulcanizarea cauciucului în fabricarea de cerneală și insecticide. După reacția cu etilena produs lichid volatil, cunoscut sub numele de gaz muștar (ClC2H4) 2S - compus toxic folosit ca un iritant chimic marțiale. sulfura de carbon CS2 (sulfură de carbon) - lichid galben pal, toxic și inflamabil. CS2 obținut printr-o sinteză a elementelor într-un cuptor electric. Substanța este insolubilă în apă, are un indice de refracție, de înaltă presiune de vapori, cu punct de fierbere scăzut (46 ° C). disulfura de carbon - eficient solvent grăsime, ulei, cauciuc si cauciuc - sunt utilizate pe scară largă pentru extracția uleiurilor în producția de mătase artificială, lac, adezivi din cauciuc și chibrituri, gărgărițelor distrugerii grânar, molii și îmbrăcăminte, pentru a dezinfecta solul. A se vedea. De asemenea, elemente chimice.
REFERINȚE
sernokislotchika Director. M. 1971 Busev AI Simon L. chimie analitică a sulfului. M. 1975